|
夏原 由博 (名古屋大学大学院 環境学研究科)
1.マダガスカルの両生類
世界で知られている両生類6242種のうち2361種が絶滅の危機に瀕している。原因として考えられているのは、生息場所の消失、気候変動(温暖化や地域的な乾燥)、外来生物、カエルツボカビ病、紫外線による影響などである。このうち、最大の要因は生息場所の消失である。マダガスカルは両生類の固有種数が多い多様性のホットスポットである。しかし、森林伐採や火入れが両生類をはじめとする野生生物の存続を脅かしている。マダガスカルの両生類について邦訳された包括的な解説があるが(アンドレオーネ 1999)、分類体系については、その後大きな改定がなされたため、Glaw and Vences(2007)によるフィールドガイドや最近の文献を読む必要がある。
マダガスカルではこれまでに312種の両生類が記載されており、そのすべてがカエル(無尾類)である。そのうち308種がマダガスカルでしか見られない固有種であり、島内での種分化と適応放散の結果であると考えられる。近年、分子遺伝学的手法の導入によって、種の記載や整理がすすみ、実際の生息種数は約500種に達すると考えられている。マダガスカル(面積59万km2)のカエルの種数は、日本(38万km2)の47種、ボルネオ(74万km2)の182種と比べても大きな値である。マダガスカルで両生類の種分化がすすんだ理由として、他の大陸から隔離された地史的な要因が考えられている。マダガスカルは1億7000万年前にはゴンドワナ大陸の中にあった。1億3000万年前にアフリカ大陸とインド亜大陸が分かれたとき、マダガスカルはインドの一部であったが、最終的に8800万年前にインド亜大陸と分かれた(Yoder and Nowak 2006)。マダガスカルに生息するカエルは、ゴンドワナ大陸が分裂する前から生息していた種がそのまま残っているという考えもあったが、現在では、6500万年前のTK(大絶滅)後に、インドやアフリカから移入したとされている(Samonds et al. 2013)。
マダガスカルの在来種のカエルは、マダガスカルガエル科Mantelidae、ヒメアマガエル科Microhylidae、クサガエル科Hyperoliidea、アフリカアカガエル科Ptychadenidae、に整理されており、加えてインドから持ち込まれた外来種であるヌマガエル科DicroglossidaeのインドトラフガエルHoplobatrachus tigerinusが知られている(Glaw and Vences 2007)。最大のグループであるマダガスカルガエル科はアオガエル科と近縁で、インドに由来するが、6000万年以上前にマダガスカルに移入したものが適応放散した。マダガスカルガエル科はMantellinaeとBoophine(Boophis属)という独立した2群を含んでいる。Mantellinaeは種数が多く、多様性が高い。Boophineは樹上性でMantellinaeと比べて、小卵多産の傾向がある。おたまじゃくしは渓流中で生活するが、卵は水中でなく樹上などに産みつけられる。しかし、モリアオガエルRhacophorus arboreusなどで見られるような泡状の卵塊で産む種は見られない。ヒメアマガエル科のカワリヒメアマガエル亜科Cophylinae とスキアシヒメアマガエル亜科Scaphiophryninaeは近縁で6000万年前にマダガスカルに到着した集団から分化したと考えられ、トマトガエル亜科Dyscophinaeはこれら2亜科とは独立にマダガスカルに到着し、マダガスカルで適応放散した。また、クサガエル科はHeterixalus属のみを含み、2200万年前にアフリカからマダガスカルに到着した。樹上性だが水田などオープンな環境に生息し、一腹卵数が多い。アフリカアカガエル科のマスカレンガエルPtychadena mascareniensisは人によって持ち込まれたと考えられていたが、マダガスカル内で遺伝的変異が大きいことから、数百万年前にアフリカから到着したものがマダガスカルで適応放散したと考えられている(Glaw and Vences 2007; Samonds et al. 2013)。
しかし、長期間の隔離のみではカエルの種数が多い理由とはならない。気候条件や地形などの条件が重要である。マダガスカルでは、東西の乾湿差や3つの高山域とそれにともなう流域の存在が、過去の気候変動とあいまって、局所的な種分化を促したと推理されている。種分化のメカニズムとして、①耐乾性の種が西部で進化して分布が拡大し、一部が湿潤な東部の気候に適応して分化、②湿潤期に分布が拡大したものが乾燥化によって隔離され種分化、③河川による分布の分断による種分化、④湿潤期に広範囲に広がった森林が乾季に孤立して種分化したなど、7つの可能性が考えられている(Vences et al. 2009)。
 |
 |
写真1:
渓流上の枝に産みつけられた卵 |
種数が多いことは、生活史の多様性とも結びついている。産卵場所も多様である。Mantellinaeの多くの種など流水性の種は、渓流上の木の葉や枝、岩などに産卵するものが多い(図1)。水中に産卵するのは、マスカレンガエル、マダガスカルクサガエルやBoophis属の一部などである。土に掘った穴に産卵するもの、樹洞や葉腋にたまった水に産卵する種もある。カワリヒメアマガエル類のように樹洞に産卵する種の中にはおたまじゃくしは餌を食べることなく、卵黄の栄養だけで変態するまで成長するものもある。Mantidactylus asperのように卵から幼ガエルが直接発生するものもいる。また、乾燥地に生息する種では、一時的な水たまりに産卵するため、小さな卵を多数産卵する傾向がみられる。興味深いことに、カワリヒメアマガエル亜科では、産卵された樹桐をオスが守る行動を示す種が知られている。また、卵を運ぶ行動が過去に報告されているというが、確認されていない。
カエルの多くは周囲に溶け込む隠ぺい色をして、夜行性だが、マダガスカルガエル科のMantela属は派手な色彩で昼行性である(図2)。このグループは、南米に住むヤドクガエルと同様に毒を持つように進化した。これらのカエルはアリを食べることによってアルカロイドを蓄積すると考えられている。
 |
 |
写真2:
色鮮やかなMantella baroni |
2.渓流に棲息するおたまじゃくし
マダガスカルの雨林地帯にあるラヌマファナRanomafana国立公園はキツネザルの棲む豊かな自然林の生態系が残されているが、伐採跡地に成立した二次林や日本の里山のような農耕地が存在する(図3、4)。そのため、人為かく乱による生態系への影響を評価するためにはうってつけの場所である。
 |
 |
写真3:
ラヌマファナ国立公園Vatoharananaの自然林 |
 |
 |
写真4:
ラヌマファナ国立公園近くAmbatolahyの農地 |
渓流には44種以上のおたまじゃくしが生息する。しかし、多種のおたまじゃくしの共存には謎が多い。たとえば、生産力が高く季節変化が少ないことが、食性や生息環境の違いなどニッチ(生態的地位)分割を引き起こしたとされる。しかし、おたまじゃくしは藻類やデトリタス(生物遺骸などが起源の微小な有機物粒子)を主とした雑食性で食性の分化が生じている証拠は乏しい。Gephyromantis azzurraeが捕食性であること以外に餌の明瞭な区別は見出されていない。しかし、餌の採取方法に関わる口器には形態の変異がみられる。一般的なおたまじゃくしの口器は、角質化したくちばしや唇歯を備えている。しかし、トマトガエル属などでのおたまじゃくしはこれらを持たず、水中の懸濁物を濾過して食べていると考えられる。また、Mantidactylusの一部には漏斗状の口器で水中の表面に浮く餌を食べるおたまじゃくしがみられる。角質化したくちばしや唇歯を欠くおたまじゃくしがいる。Boophis picturatusもそのひとつで、この種は砂を食べ、間隙中の有機物を砂ですりつぶして消化していると推測されている。
そこで、生息場所と口器形態からニッチの区分が試みられたが、種間で大きな重複が見られた(Straus 2013)。これは、ニッチが重複する種は共存できないという競争排除則と相容れない。マダガスカルで種数が多い他の要因として、渓流魚が少なく、おたまじゃくしへの捕食圧が低いこともあげられている(Vences et al. 2009)。しかし、Paine(1966)の実験などに見られるように、捕食は餌生物間の競争を緩和し共存させる要因となる。おたまじゃくしの種間関係について新しい仮説を検討する必要が生じている。
渓流の食物連鎖は、藻類による光合成と落葉など外部からもたらされた有機物からはじまるものに分けることができる。また、水生動物は藻類食や落葉食などに機能分化するが、水生動物の排泄物が藻類の生産を促すなど機能的多様性が生態系の機能を高める事実が注目されている。おたまじゃくしは生態系エンジニアであり、物理的環境を改変することによって他の生物にとっての資源の状態を改変する。したがって、その減少は水中生態系全体に影響を及ぼす。パナマでは,ツボカビによる両生類の大量死によって付着性藻類相が変化しただけでなく,カゲロウなど水生生物相への影響が8年後も回復していないことが明らかにされている(Rantala et al. 2015)。
私たちは、ラヌマファナの渓流での多種の両生類の共存機構を食性ニッチの違いから解明したいと考えた。マダガスカルでは、森林伐採圧が高く、生物多様性への影響が危惧されている。そこで、森林の変化がおたまじゃくしの種組成変化を通じて、種間相互作用や水中生態系全体に影響が生じないだろうか。種多様性が生態系機能を高めるという仮説を実証したいと考えている。そして,両生類の種ごとに渓流内食物連鎖への影響が異なることを明らかにし、森林の改変による両生類成体にとっての生息環境の変化が,幼生期の種間関係を変化させることを通じて,おたまじゃくしの食性の重複を生じさせ,特殊化した種の絶滅とジェネラリストの増加を招くことを予想している。さらに,生態系エンジニアとしてのおたまじゃくしの種数減少が渓流生態系に及ぼす影響を明らかにしたいと考えている。
ラヌマファナ国立公園にはアメリカのストーニーブルック大学の研究施設Centre ValBioがある(図5)。ここでは、研究や研究者の受け入れ以外に、地域の人々への教育やNPOの養成、雇用創出などの役割も果たしている。私たちはここに滞在し、国立公園内での調査許可や標本の国外持ち出し許可などでもお世話になった。
 |
 |
写真5:
中央高地南部(ベツィレオ族の地域)にみられる棚田風景 |
2014年10月と2015年3月に渓流でおたまじゃくしの分布調査を行った。自然林、二次林、農耕地のそれぞれにおいて3支流を選び、瀬と淵それぞれ4地点でサンプリングを実施した。各調査地点で、おたまじゃくしと底生動物を採集するとともに、周辺植生や流速、水質を測定し、餌候補として付着藻類、浮遊粒子、デトリタス、落葉などを採取した。捕獲したおたまじゃくしは写真撮影し、麻酔薬によって処理した後、組織片を採取した。また、夜間に鳴き声の聞き取りによるカエル調査を行った。自然林はValBioから離れたところにあるため、キャンプ地に泊まって調査を行った。マダガスカルというとバオバブや水田のイメージが強いが、夏のラヌマファナは毎日霧がかかり雨が降る。神秘的な風景だが、上からも下からもヒルが襲いかかるので気が抜けない。宿舎に帰って雨具をぬぐとたいていTシャツが血で染まっている。しかし、ランの花(図6)や夕暮れとともに聞こえるカエルの声など魅力も多い。
 |
 |
写真6:
ラヌマファナ国立公園に咲くラン |
2014年10月の調査では、4515個体のおたまじゃくしを採集した(図7)。おたまじゃくしの外部形態によって48タイプに分けられたが、同じ種でも色彩などが異なる場合があるので、DNAによる種の同定を実施中である。外部形態より識別した支流あたり平均タイプ数と個体数は、自然林24タイプ1900個体、二次林12.3タイプ1484個体、農耕地17.3タイプ1131個体であった。いずれの地点でも瀬より淵でタイプ数と個体数が多かった。自然林でタイプ数、個体数とも多く、農地では林内で優占となっているタイプや砂食の種が減少し、地上部の改変が水中の生態系に影響を及ぼしている可能性が示唆された。
 |
 |
写真7:
採集したおたまじゃくしの一部 |
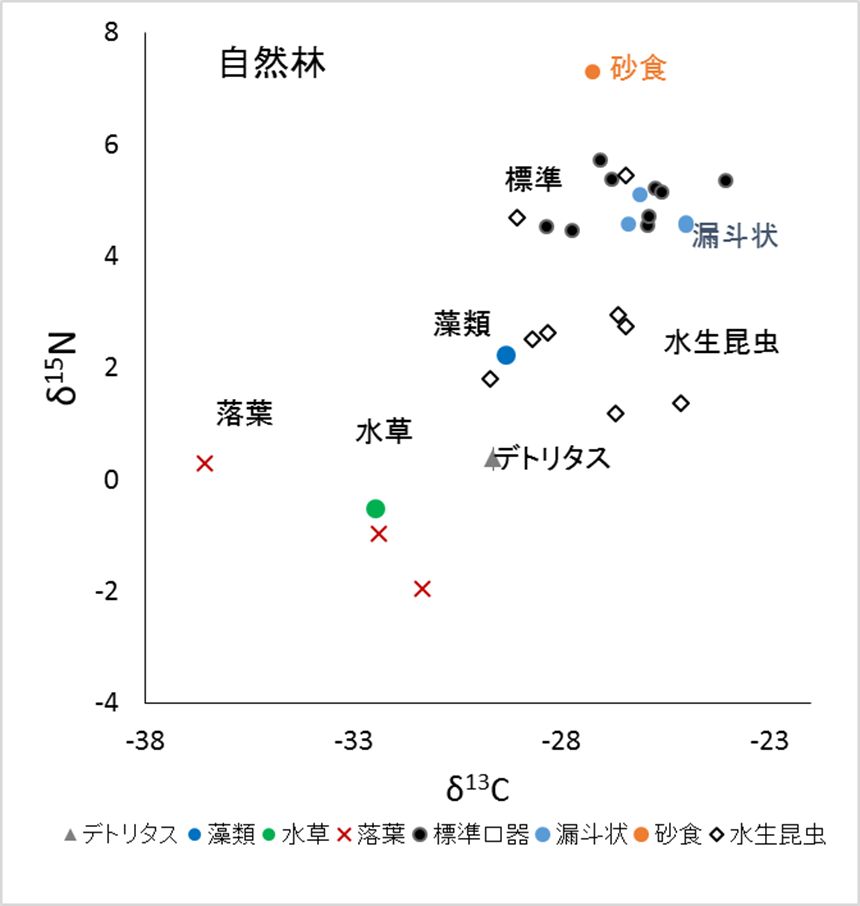
採集したおたまじゃくしの口器の形態は大きく5種類に分けられ,食性の分化が示唆された。何を食べているかを推定するために、おたまじゃくしの筋肉と餌候補の安定同位体比を測定した。炭素安定同位体比δ13Cの比率は植物のタイプによって異なるため、食物連鎖の出発点が陸上植物か水中の藻類かなどを識別できる。また、窒素安定同位体比δ15Nは食物連鎖が1段階上がるごとに高まるため、植食性か捕食性(肉食性)かなど食物連鎖の位置が推定できる。
一般型の口器を持つ種は、種によって炭素同位体比の大きく異なったが、窒素同位体比の違いは小さく、主に藻類や昆虫(死体)を食べていることが示唆された(図8)。落葉を主たる餌とする種は見られなかった。漏斗型口器をもつ種は、炭素同位体比の違いが小さく、餌の種類がより限られていることが示唆された。急流に生息する吸盤型口器をもつ種は、一般型より窒素同位体比が小さく、餌中の付着藻類の割合が大きいことが示唆された。砂食型のBoophis picturatusは窒素同位体比が大きく、分解者である微生物あるいは動物遺骸を主に食べていることが推測され、従来考えられたように間隙中の珪藻が主たる餌ではないことが明らかとなった。
 |
 |
写真8:
おたまじゃくしと餌の安定同位体比 |
また、2015年10月に囲い込み実験を実施した。ラヌマファナ国立公園内の渓流(2次谷)にポリエチレン網(2 mmメッシュ)を用いた25 cm x 25 cmの囲いを設置した。囲い内の大型水生生物を除去した後、おたまじゃくしを投入して、25日間観察した。投入したおたまじゃくしは落葉を食べないにもかかわらず、落葉の消費が促進された。これは、おたまじゃくしの排泄物中に含まれる窒素が落葉表面の微生物を増加させたためではないかと考えている。
引用文献
アンドレオーネ, フランコ(1999)(森哲訳)マダガスカルの両生類、山岸哲(編)マダガスカルの動物―その華麗なる適応放散―裳華房 213-261
Glaw F, Vences M (2007)A Field Guide to the Amphibians and Reptiles of Madagascar(3rd edition). Vences & Glaw,
Paine RT (1966) Food web complexity and species diversity. The American Naturalist 100, 65-75
Rantala HM et al. (2015) Long-term changes in structure and function of a tropical headwater stream following a disease-driven amphibian decline.Freshwater Biology 60, 575-589
Samonds KE, Godfrey LR, Ali JR, Goodman SM, Vences M, et al. (2013) Imperfect Isolation: Factors and Filters Shaping Madagascar’s Extant Vertebrate Fauna.PLoS ONE 8(4): e62086. doi:10.1371/ journal.pone.0062086
Straus A, Randrianiaina RD, Vences M Glos J (2013) Species distribution and assembly patterns of frog larvae in rainforest streams of Madagascar. Hydrobiologia702, 27-43
Vences M, Wollenberg KC, Vieites DR, Lees DC (2009) Madagascar as a model region of species diversification. TREE 24, 456-465
Yoder AD, Nowak MD (2006) Has vicariance or dispersal been the predominant biogeographic force in Madagascar? Only time will tell. Annual Review of Ecology, Evolution, and Systematics37, 405-431
▲ページトップへ
|