|
加藤 康幸 (国際医療福祉大学)
1.はじめに
2019年3月に厚生労働省において、1類感染症検討会が開催されました。1類感染症とは、患者に入院措置を執行するなどの強い権限が国や自治体に認められている公衆衛生上重大な感染症を指し、エボラ出血熱などと並んでペストが含まれています。私はペスト患者を診療する際に医療従事者が着用する個人防護具のガイダンスをまとめた関係で、参考人として出席しました。なぜ、今ペストのことが国において検討されているのかといいますと、そのきっかけは2017年に発生したマダガスカルにおける肺ペストのアウトブレイクです。リスクは小さいですが、ペストの国際的な伝播が懸念され、地理的に遠く離れた日本にも影響を及ぼしたのです。
2.ペストとは
ペストはペスト菌Yersinia pestis による感染症です。げっ歯類とノミによって感染環が維持されている動物由来感染症であり、特にクマネズミRattus rattus とケオプスネズミノミ Xenopsylla cheopisが人の感染にとって重要です(図1)。感染ノミに咬まれたあとリンパ節が腫大する腺ペストと、患者が咳をする際の飛沫を吸入して肺炎を発症する肺ペストに大別されます。いずれも潜伏期は6日以内で、有効な抗菌薬が早期に使用されないと、多くの患者が敗血症を起こし、死に至ります。このような患者では四肢末端が壊疽を起こし、黒く炭化することがあり、黒死病の由来と考えられています(図2)(加藤 2017)。
 |
図1
クマネズミとケオプスネズミノミ ケオプスネズミノミが主に吸血するクマネズミの生息域は広く、人と野生げっ歯類のそれとも重なる。米国公衆衛生画像ライブラリー(PHIL)から引用(ID#14282, 4633) |
 |
 |
図2
敗血症を合併したペスト患者における黒色炭化した手(米国:59歳男性)。米国公衆衛生画像ライブラリー(PHIL)から引用(ID#16551) |
ペストはこれまでに少なくとも3回の世界的流行を起こしたことが知られています。5世紀の東ローマ帝国のユスティニアヌス帝の疫病、14世紀の黒死病、19世紀の香港を起点とした流行です。ペスト菌は中国、あるいは西アジア起源と考えられていますが、現在では世界の幅広い地域に常在地を認めます。これには3回目の流行が大きく関与しています。当時、初めてペストの侵入を経験したのは日本であり、マダガスカルでした。日本は制圧に成功しましたが、マダガスカルは野生げっ歯類にもペスト菌が伝播し、現在でも患者報告数が最も多い(年間約300名)国となっています。日本は開国間もない頃でしたが、北里柴三郎博士を香港に派遣するなど、すでに感染症の制圧では世界をリードする国になっていました。
3.マダガスカルにおけるペスト
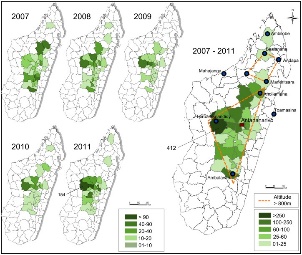
マダガスカルに初めてペストが侵入したのは1898年のトアマシナToamasina(当時タマタブTamatave)と考えられています。当時、ペストが大流行していたインドから船舶によって輸入されたと考えられます。その後の道路及び鉄道建設に伴って、間もなくペストは標高800 mを超える中央高地に達しました。この地が現在のペスト菌の主要な常在地であり、クマネズミとケオプスネズミノミによって感染環が維持されています(図3)(Andrianaivoarimanana et al. 2013)。都市部のアンタナナリヴAntananarivoとマハジャンガMahajanga(マジュンガMajunga)でも患者の散発的な発生があります。ここではドブネズミ R. norvegicus とケオプスネズミノミによって感染環が維持されており、マジュンガではジャコウネズミ Suncus murinus の関与も疑われています。また、森林地帯でも感染環が維持されており、クマネズミに加えて、ハリテンレック Setifer setosus などの小型哺乳類も関与していることがわかっています。このように、ペスト菌はマダガスカルの都市や農村、森林等の環境に深く入り込んでおり、根絶は難しいと考えられます。例年、患者の90%以上は腺ペストであり、その多くは中央高地に住む農民です。明瞭な季節性が認められ、患者は9月~3月に多く、雨季に少ない傾向を示します(Andrianaivo- arimanana et al. 2019)。
 |
 |
図3
マダガスカルにおける患者発生地(2007-2011)
破線で囲まれた標高の比較的高い地域が主な患者発生地である。Andrianaivoarimanana 2013から引用(Creative Commons Attribution License)
|
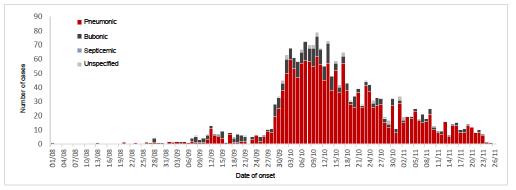
一方、2017年の流行は都市部(アンタナナリヴとトアマシナ)に患者が集積したこと、肺ペストが約80%を占めたこと、など例年の患者発生パターンとは大きく異なりました。最初の患者は8月に中央高地で感染し、肺ペストを発症した31歳の男性であったと考えられています。飛沫感染によって、乗合バスに同乗した客から複数の患者が発生し、9月になってアウトブレイクが検知されました。11月に収束するまで、約2,400名の患者が報告され、致死率は約10%でした(WHO Africa 2017)。世界保健機関(WHO)の報告では、流行地に居住するなど疫学上の関連があるのみで微生物学的検査が行われていない疑い患者が全体の約半数であり、ペスト菌陽性と確定診断された患者が少ないのが実態です。パスツール研究所の研究者による報告では実際のペスト患者数はこれより少ない可能性があることも指摘されています(Randremanana et al. 2019)。肺ペストは他の病原体による肺炎と臨床的には区別が困難です。マダガスカルなどの開発途上国では設備を要する微生物学的診断を行うことは一般に困難なため、簡易検査の開発が課題となっています。
 |
図4
ペスト患者報告数(日別) 棒グラフの底部(Pneumonic)が肺ペスト患者数を示す。肺ペストが全体の62%を占め、腺ペストは15%に過ぎなかった。なお、24%は分類不明で報告されている。WHO Africa 2017より引用 |
4.感染症アウトブレイクに対する国際協力
今回のようなアウトブレイクの制圧にはWHOが重要な役割を果たしています。肺ペストのように予防接種がなく、人から人に感染する疾患の制圧には、患者の治療と隔離、接触者調査、遺体の安全な埋葬、社会啓発を着実に実施することが基本方針となります。感染症発生国からの要請に応じて、WHOは専門家を派遣します。世界中の研究機関等から短期専門家をリクルートするGlobal Outbreak Alert and Response Network(GOARN)という仕組があり、私も2014年に西アフリカでエボラ出血熱が流行した際にリベリアに派遣されたことがあります。マダガスカルがフランス語圏だったこともあり、今回は日本の専門家が関与できる機会は少なかったと考えられます。患者の治療は国境なき医師団、微生物学的診断はマダガスカルに支所を持つパスツール研究所の専門家が大きな貢献をしたようです。
西アフリカにおけるエボラ出血熱の流行では日本から派遣された専門家や医療従事者が諸外国に比べて少なかったことが課題とされ、政府は2015年に国際的に脅威となる感染症対策関係閣僚会議を立ち上げました。国際緊急援助隊に感染症対策チームが設置され、感染症専門家をアウトブレイク発生国に迅速に派遣する体制が整えられつつあります。約100年前に北里博士を香港に派遣したような発生地における感染症対策を、国はもう一度真剣に考え始めたと言っていいのかもしれません。
おわりに
ペスト患者がマダガスカルで発生し続けているという課題に適切に対処するためには、医学や獣医学領域にとどまらず、学際的な研究が必要と考えられます。今回のアウトブレイクの背景には人口増加や貧困、開発の問題があると思われるからです。本懇談会の今後の活動に期待したいと思います。
最後にマダガスカルに渡航されることも多い皆さんにペストの予防についてふれます。ペストは一般旅行者が容易に感染するものではありません。2017年のアウトブレイクにおいてもスポーツ大会参加者に1名の外国人患者が確認されましたが、マダガスカルで感染し外国でペストを発症した患者はいませんでした。しかし、特に乾季に中央高地などの常在地に滞在する方では、げっ歯類(特に死骸)に直接触れない、ノミに刺されないようにするなどの注意が必要です。患者に接触した場合には抗菌薬の予防内服が行われることがあります。マダガスカルはマラリアやA型肝炎など、蚊や食品から感染する疾患がまだ多いので、渡航前に予防接種や予防薬の処方を受けることが推奨されます。
参考文献
加藤康幸 2017. ペスト. 感染症 47: 33-43
Andrianaivoarimanana V, et al. 2013.
Understanding the persistence of plague foci in Madagascar. PLoS Negl Trop Dis 7: e2382
Andrianaivoarimanana V, et al. 2019. Trends of human plague, Madagascar, 1998-2016. Emerg Infect Dis 2: 220-228
WHO Africa 2017. Plague outbreak Madagascar: External situation report.
https://apps.who.int/iris/bitstream/handle/10665/259556/Ex-PlagueMadagascar04122017.pdf;jsessionid=EE40620C0F299C61DDD5CA1B3D66940D?sequence=1
Randremanana R, et al. 2019. Epidemiological characteristics of an urban plague epidemic in Madagascar, August-November, 2017: an outbreak report. Lancet Infect Dis [on line]
▲ページトップへ
|
